
2023年8月16日,來自澳大利亞克萊頓的哈德遜醫學研究所Paul J. Hertzog及其研究組在學術期刊《自然》雜志發表了標題為"Interferon-ε is a tumour suppressor and restricts ovarian cancer."的研究成果,揭示干擾素-ε(IFNε)是一種腫瘤抑制因子,可限制卵巢癌。
研究人員表示,卵巢高級別漿液性癌的存活率較低,因為它們癥狀出現的較晚并伴有廣泛的腹膜轉移和高頻化學抵抗,急需基于發病機制為指導的新療法。
研究人員揭示了IFNε的內在腫瘤抑制活性。IFNε在輸卵管上皮細胞中組成型表達,輸卵管是高級別漿液性卵巢癌的起源細胞,然后其在腫瘤進展過程中丟失。研究人員在以下幾種臨床前模型中表征了其抗腫瘤活性,包括卵巢癌患者來源的異種移植物、原位和擴散同系模型、以及具有或不具有Trp53和Brca基因突變的腫瘤細胞系。研究人員在不同細胞區室中對IFNε受體IFNAR1進行了操控,IFNε的差異暴露狀態和IFN信號傳導的全局測量證明IFNε的抗腫瘤活性直接作用于腫瘤細胞,并且激活抗腫瘤免疫。
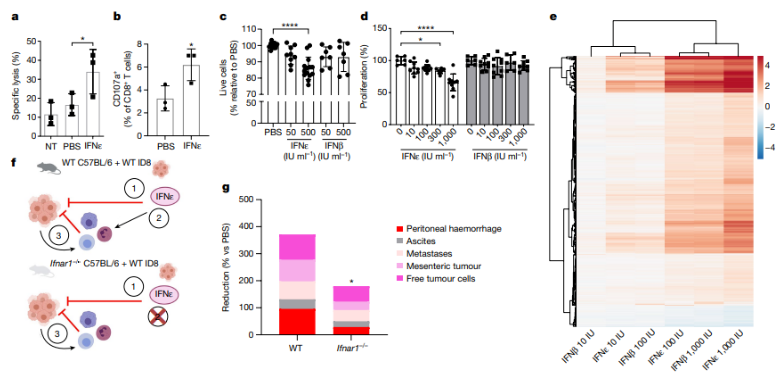
傳統的I型干擾素通常通過直接影響腫瘤細胞或間接調控免疫細胞來抑制腫瘤生長,但IFNε的這些作用尚未被深入研究。研究通過廣泛的免疫表型分析發現,在攜帶腫瘤的小鼠中,腹腔內免疫細胞數量增加,包括CD8+和CD4+ T淋巴細胞、自然殺傷細胞、單核細胞、中性粒細胞和髓源性抑制細胞(MDSCs)。IFNε在已確立的腫瘤模型中減少了免疫細胞數量,但在發展中或先進的模型中只顯示出較小的趨勢。然而,接受IFNε治療的小鼠中的免疫細胞被顯著激活,表現為CD4+和CD8+ T細胞以及自然殺傷細胞上CD69表達的增加。此外,腹腔內的CD4+ T細胞也顯示出免疫檢查點分子PD-1的增加。
IFNε的抗腫瘤活性機制
研究還展示了IFNε對腹腔內細胞毒性淋巴細胞的功能激活。通過對接受IFNε或PBS治療的小鼠的腹腔滲出細胞(PECs)進行實驗,研究發現接受IFNε治療的小鼠的腹腔細胞對ID8細胞的溶解能力增加,細胞毒性CD8+ T細胞和自然殺傷細胞上的CD107a表達也增加。因此,IFNε不僅在腫瘤模型中調節了激活的抗腫瘤免疫細胞的比例,還在功能上激活它們來殺死腫瘤細胞。
此外,研究還揭示了IFNε對腫瘤細胞的直接抑制作用。IFNε對ID8腫瘤細胞誘導了劑量依賴的凋亡,減少了活細胞的比例,并表現出抗增殖效應。這些效應涉及與細胞周期、增殖、存活和凋亡等相關的基因表達的改變。IFNε在體外分子和功能抗腫瘤試驗中的效應更強大,與其他I型干擾素相比,尤其是IFNβ。
研究還使用Ifnar1?/?小鼠探究了IFNε的直接和間接抗腫瘤作用。結果顯示,盡管在缺乏Ifnar1的小鼠中,IFNε不能直接影響免疫細胞,但它仍然通過直接作用于腫瘤細胞抑制了腫瘤的發展。然而,IFNε的間接效應,如抗腫瘤免疫應答,也在抗腫瘤效應中發揮了重要作用。
IFNε激活抗腫瘤T細胞和自然殺傷細胞,阻止髓源性抑制細胞和調節性T細胞的積累和活化。因此,研究證明IFNε是女性生殖道中的內在腫瘤抑制因子,其在已患病和晚期卵巢癌模型中的活動與其他I型IFN不同,是治療卵巢癌的潛在新方法。
文章來源:
Marks, Zoe R. C., Campbell, Nicole K. et al , Interferon-ε is a tumour suppressor and restricts ovarian cancer. DOI: 10.1038/s41586-023-06421-w. Nature:最新IF:69.504